L’osteoporosi, ma sarebbe forse più opportuno definirla come sindrome da fragilità ossea, è non solo una condizione caratterizzata da bassa massa ossea ma anche dal deterioramento micro-architettonico del tessuto osseo; queste condizioni determinano un aumentato rischio di frattura.
La causa di entrambe è dovuta a uno squilibrio nel processo di rimodellamento osseo, distorto e sbilanciato verso la perdita ossea in assenza di una adeguata fase ricostruttiva.
Studi recenti e prove emergenti dimostrano costantemente il potenziale del microbiota intestinale per modulare la salute delle ossa. Questi studi si basano sia su prove sperimentali che su valutazioni epidemiologiche.
È ormai nota da tempo la correlazione tra alcune patologie dell’apparato digerente e la sindrome da fragilità ossea.
In tutte le cosiddette Inflammatory Bowel Desease (IDB, malattie infiammatorie intestinali), nella Celiachia e nelle sindromi acquisite da malassorbimento e nell’Anoressia Nervosa, ad esempio, l’incidenza dell’osteoporosi è molto più alta che nella popolazione comune.
Molti studi sino ad ora condotti hanno chiaramente dimostrato che il tratto intestinale può influenzare profondamente la salute dell’osso. Ciò avviene attraverso la regolazione dell’assorbimento di minerali che è richiesto per la salute del tessuto osseo e include, ad esempio, calcio, fosforo e magnesio, ed è forse la via più nota ed intuitiva.
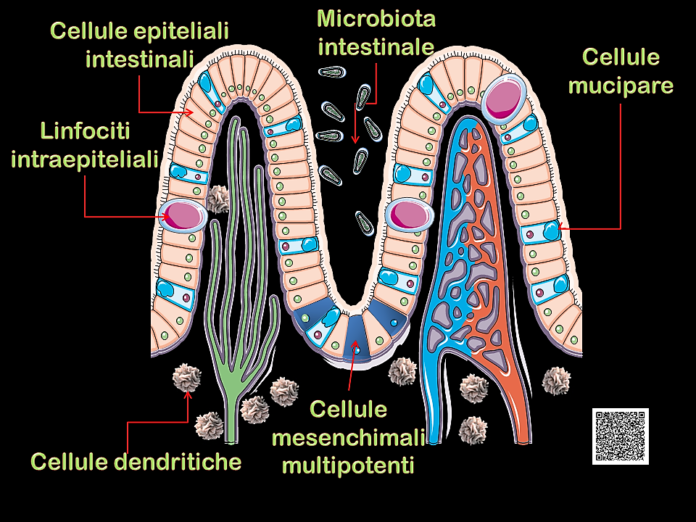
Ma il pool di batteri che vivono in simbiosi nel nostro intestino ha anche altre funzioni meno conosciute e che stanno emergendo.
Recentemente è stata messa in evidenza la stretta correlazione tra batteri probiotici, sistema immunitario e tessuto osseo, coniando i termini di osteoimmunologia e osteomicrobiologia per indicarne gli stretti rapporti.
I batteri probiotici e le sostanze che essi secernono interagiscono con le cellule dendritiche, cellule deputate a rapportare gli antigeni alle cellule T del sistema immunitario, modulandone la risposta.
Un ulteriore meccanismo di azione dei probiotici è attraverso la sovra regolazione delle proteine a giunzione stretta (tight junction), aumentando la forza dello strato epiteliale intestinale e portando a una minore presentazione dell’antigene e una minore attivazione delle cellule immunitarie intestinali.
Ciò si traduce in una riduzione delle citochine pro-infiammatorie che portano, tra l’altro, ad un alterato assorbimento di minerali dal lume intestinale. Accanto a molte interleuchine viene modulata verso il basso anche la produzione del TNF-α, che rappresenta un elemento fondamentale nel causare uno squilibrio in senso riassorbitivo del metabolismo osseo stimolando la migrazione e la maturazione dei macrofagi verso il tessuto osseo dove poi diventeranno osteoclasti.
Sull’altro versante invece l’attività dei probiotici porta ad un incremento dell’IGF-1, probabilmente attraverso la produzione di short-chainfattyacids (SCFAs, o acidi grassi a catena corta); l’InsulinGrouthFactor 1 (IGF-1) rappresenta un’importante stimolo alla maturazione degli osteoblasti.
Ma non solo. I batteri sono anche responsabili della sintesi di numerose vitamine ed enzimi che sono necessari per la formazione della matrice e della crescita ossea, tra cui le vitamine D, K (ed in particolare la K2), C ed i folati e di fattori con funzione endocrina come le incretine e la serotonina.
Tra le incretine spicca il ruolo del glucagon-like peptide-1 (GLP-1) che agisce sia incrementando il fattore di trascrizione nucleare che da il via alla maturazione degli osteoblasti ed il fattore di attivazione degli stessi (la proteina WNT-10) sia inibendo e riducendo sclerostina e DKK che rallentano, in parte bloccandola, la trasformazione da preosteoblasti in osteoblasti maturi.
I batteri probiotici inoltre favoriscono la sintesi della serotonina a partire dal triptofano, serotonina che per via sistemica, raggiunto il sistema nervoso può essere trasformata in melatonina (molecola che attiva gli osteoblasti e riduce lo stress ossidativo) e in ambito locale viene dagli stessi probiotici trasformata in acido 3-indolpropionico (IPA) capace di una potente attività antiossidante caratterizzata in aggiunta della caratteristica di non necessitare di prodotti intermedi della degradazione delle specie reattive dell’ossigeno.
Infine, da non trascurare, anche se in parte da dimostrare, il ruolo importante rappresentato dalle cellule mesenchimali multi potenti presenti nel fondo delle cripte intestinali, le uniche, congiuntamente a quelle del midollo, che hanno capacità di maturare in varie forme cellulari tra le quali gli osteoblasti. Su di esse è probabile l’azione di tamponamento dello stress ossidativo esercitata da un gut microbiota sano che, inibendo il PPAR-γ,blocca la trasformazione delle cellule mesenchimali inadipociti favorendone invece quella in osteoblasti portando quindi il metabolismo osseo ad indirizzarsi maggiormente in senso anabolico.
Una flora batterica intestinale di “qualità” è fondamentale per un corretto ed equilibrato metabolismo osseo e la correzione del gut microbiota entra a buon diritto a far parte delle terapie dell’osteoporosi. All’orizzonte della ricerca si affaccia la capacità di influire sulla nostra risposta genetica (la ormai nota epigenetica) e le correlazioni tra allergopatie ed osteoporosi (come ad esempio dimostrato da un recente lavoro su dermatite atopica ed osteoporosi) avendo come elemento comune una attività dei batteri intestinali non corretta.